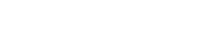Geral
- Publicada em 09 de Novembro de 2020 às 22:31Anvisa interrompe testes da vacina Coronavac após 'evento adverso grave'
No Rio Grande do Sul, Porto Alegre e Pelotas participam dos testes da imunização
LUIZA PRADO/JC
A Anvisa (Agência Nacional de Vigilância Sanitária) informou na noite desta segunda-feira (9) que determinou a interrupção do estudo clínico da vacina chinesa Coronavac após a ocorrência de evento adverso grave. Em Porto Alegre, os testes da vacina são realizados no Hospital São Lucas da Pucrs. A Universidade Federal de Pelotas (UFPel) também integra o rol de centros que aplicam a Coronavac.
Quer continuar lendo este e outros conteúdos sérios e de credibilidade?
Assine o JC Digital com desconto!
Assine o JC Digital com desconto!
- Personalize sua capa com os assuntos de seu interesse
- Acesso ilimitado aos conteúdos do site
- Acesso ao Aplicativo e versão para folhear on-line
- Conteúdos exclusivos e especializados em economia e negócios
- Cancelamento on-line e a qualquer momento
A Anvisa (Agência Nacional de Vigilância Sanitária) informou na noite desta segunda-feira (9) que determinou a interrupção do estudo clínico da vacina chinesa Coronavac após a ocorrência de evento adverso grave. Em Porto Alegre, os testes da vacina são realizados no Hospital São Lucas da Pucrs. A Universidade Federal de Pelotas (UFPel) também integra o rol de centros que aplicam a Coronavac.
Esse evento, ocorrido no dia 29 de outubro, foi comunicado à agência, que decidiu pausar o estudo para avaliar os dados e julgar sobre o risco/benefício da continuidade do estudo. Com a interrupção, nenhum novo voluntário poderá ser vacinado.
Segundo a Anvisa, os eventos adversos graves são óbitos, incapacidade/invalidez persistente ou significativa, exigência de internação hospitalar do paciente ou prolonga internação, anomalia congênita ou defeito de nascimento e qualquer suspeita de transmissão de agente infeccioso por meio de um dispositivo médico.
A Coronavac, que é produzida pela chinesa Sinovac e será desenvolvida no Brasil pelo Instituto Butantan, em São Paulo, é a aposta do governador João Doria (PSDB) para controlar a pandemia e virou alvo de críticas por parte do presidente Jair Bolsonaro (sem partido), seu rival político.
Procuradas, a Secretaria da Saúde de São Paulo e o Instituto Butantan ainda não se manifestaram sobre o assunto.
Segundo a nota divulgada pela Anvisa, esse tipo de interrupção é prevista pelas normativas da Anvisa e faz parte dos procedimentos de Boas Práticas Clínicas esperadas para estudos clínicos conduzidos no Brasil.
"A Anvisa reitera que, segundo regulamentos nacionais e internacionais de Boas Práticas Clínicas, os dados sobre voluntários de pesquisas clínicas devem ser mantidos em sigilo, em conformidade com princípios de confidencialidade, dignidade humana e proteção dos participantes", afirma. "A Anvisa mantém o compromisso com o Estado brasileiro de atuar em prol dos interesses da saúde pública."
O acordo com o governo estadual de São Paulo prevê 46 milhões de doses vindas da China. O governador gaúcho Eduardo Leite chegou a projetar que a vacina chegaria ao Estado no primeiro trimestre do próximo ano. O Butantan tem capacidade para produzir mais 60 milhões de doses até maio de 2021.
Folhapress