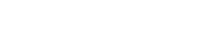Geral
- Publicada em 14 de Outubro de 2020 às 18:26Ventilador pulmonar produzido em Caxias do Sul é aprovado pela Anvisa
Testes clínicos foram realizados no Hospital Geral em maio, inclusive com pacientes de UTI
Divulgação UCS/HG /JC
Roberto Hunoff
A Agência Nacional de Vigilância Sanitária (Anvisa) liberou a produção em série e distribuição do ventilador pulmonar Frank 5010, desenvolvido por um grupo de professores da Universidade de Caxias do Sul (UCS), engenheiros e empresários voluntários, sob orientação da direção técnica do Hospital Geral (HG). O registro do equipamento, datado do dia 9 de outubro, foi publicado no Diário Oficial da União da terça (13). No final da tarde desta quarta (14), uma reunião do grupo de gestão do projeto tratou da produção e destinação de unidades do aparelho, concebido para o atendimento de urgência e emergência de pacientes acometidos pela síndrome aguda respiratória grave induzida pela Covid-19, com necessidade de intubação.
Quer continuar lendo este e outros conteúdos sérios e de credibilidade?
Assine o JC Digital com desconto!
Assine o JC Digital com desconto!
- Personalize sua capa com os assuntos de seu interesse
- Acesso ilimitado aos conteúdos do site
- Acesso ao Aplicativo e versão para folhear on-line
- Conteúdos exclusivos e especializados em economia e negócios
- Cancelamento on-line e a qualquer momento
A Agência Nacional de Vigilância Sanitária (Anvisa) liberou a produção em série e distribuição do ventilador pulmonar Frank 5010, desenvolvido por um grupo de professores da Universidade de Caxias do Sul (UCS), engenheiros e empresários voluntários, sob orientação da direção técnica do Hospital Geral (HG). O registro do equipamento, datado do dia 9 de outubro, foi publicado no Diário Oficial da União da terça (13). No final da tarde desta quarta (14), uma reunião do grupo de gestão do projeto tratou da produção e destinação de unidades do aparelho, concebido para o atendimento de urgência e emergência de pacientes acometidos pela síndrome aguda respiratória grave induzida pela Covid-19, com necessidade de intubação.
Foram seis meses e meio de trabalho desde a idealização da proposta, em 24 de março. O primeiro protótipo, baseado em um modelo usado até os anos 1990, devido à disponibilidade de peças no mercado, menor custo e maior velocidade de desenvolvimento, foi apresentado no início de abril. No mesmo mês, foram realizados os primeiros ensaios certificados no complexo de Laboratórios Especializados em Eletroeletrônica, Calibração e Ensaios (Labelo) da Pontifícia Universidade Católica do Rio Grande do Sul, em Porto Alegre.
Após testes clínicos autorizados pela Comissão Nacional de Ética em Pesquisa, realizados no Laboratório de Anatomia da UCS e no HG, em maio e junho, inclusive com pacientes internados em unidades de tratamento intensivo (UTI), o Frank 5010 passou por ensaios de compatibilidade eletromagnética no Instituto Eldorado, um dos principais centros de pesquisa, desenvolvimento e inovação do país, em Campinas (SP).
Com os aperfeiçoamentos de funcionalidade, confiabilidade e segurança, o laudo técnico foi remetido à Anvisa no final de junho. No mesmo período, o projeto foi um dos quatro do país selecionados para receber aporte de R$ 100 mil do Instituto Brasileiro de Petróleo, da Petrobrás, como apoio à pesquisa clínica, registro e fabricação.
De acordo com o coordenador do curso de Engenharia Mecânica e Automotiva da UCS, Alexandre Viecelli, responsável pelo monitoramento dos testes e redação final da documentação, uma mudança da Anvisa, anunciada em nota técnica emitida em 10 de julho, restabelecendo exigências de segurança elétrica e desempenho necessárias aos ventiladores pulmonares, foi a responsável pela extensão do prazo de testes e ajustes. "Começamos fazendo determinado produto, destinado ao atendimento emergencial. Porém, na medida em que a pandemia foi sendo melhor entendida, a situação foi mudando. A Anvisa, que tinha flexibilizado parte da norma técnica para equipamentos eletromédicos, em 19 de março, voltou a exigi-la completa no começo de julho", esclarece.
Nesse período, foram realizados ensaios na área elétrica, voltados ao funcionamento e à segurança para o operador e o paciente, de desempenho e ajustes mecânicos. O Frank 5010 também foi o primeiro equipamento a ter executado, no Labelo, um ensaio de ciclo de vida de software, de acordo com a norma internacional ISO-62304, também requerido pela Anvisa. Os laudos finais e o manual técnico atualizado foram encaminhados à agência em 28 de setembro e, agora, homologados.
Capacidade de produção inicial de 50 unidades
O registro na Anvisa viabiliza a fabricação industrial e o uso hospitalar do Frank 5010. Com estimativa de custo de R$ 20 mil por unidade, o grupo de trabalho tem componentes para produzir 50 unidades nas próximas semanas, quantidade que pode ser aumentada mediante demanda. Com as alterações no projeto, o equipamento pode ser utilizado também em pacientes com outras enfermidades respiratórias que não a causada pela Covid-19.
Os recursos para o desenvolvimento do Frank 5010 foram repassados pela Fundação Universidade de Caxias do Sul e complementados por contribuições do Sindicato das Indústrias Metalúrgicas, Mecânicas e de Material Elétrico de Caxias do Sul e Região. Também houve doação de componentes pelas Empresas Randon e Viezzer Engenharia e pelo Sindicato da Indústria da Construção Civil de Caxias Sul.
O desenvolvimento técnico do equipamento reuniu diretamente 12 empresários das áreas de engenharia mecânica, eletrônica, pneumática e mecatrônica, metalurgia, usinagem de alta precisão e tecnologia da informação. Cerca de 30 outras empresas e pessoas físicas contribuíram no andamento do projeto.