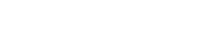Coronavirus
- Publicada em 12 de Março de 2021 às 12:47Anvisa aprova registro do remdesivir, primeiro remédio indicado em bula para Covid-19
Remédio é indicado para pessoas hospitalizadas que precisam de suporte de oxigênio
Ulrich Perrey/POOL/AFP/JC
Atualizada às 14h
Quer continuar lendo este e outros conteúdos sérios e de credibilidade?
Assine o JC Digital com desconto!
Assine o JC Digital com desconto!
- Personalize sua capa com os assuntos de seu interesse
- Acesso ilimitado aos conteúdos do site
- Acesso ao Aplicativo e versão para folhear on-line
- Conteúdos exclusivos e especializados em economia e negócios
- Cancelamento on-line e a qualquer momento
Atualizada às 14h
Além de ter anunciado a aprovação do registro da vacina de Oxford/AstraZeneca, a Agência Nacional de Vigilância Sanitária (Anvisa) também disse nesta sexta (12) ter aprovado o primeiro medicamento que poderá ser usado em pacientes de Covid-19, o remdesivir. Os detalhes ainda estão sendo anunciados.
"É o primeiro medicamento aprovado com indicação em bula para Covid-19", diz Gustavo Mendes, gerente-geral de medicamentos da Anvisa. Segundo ele, a aprovação indica que o medicamento teve dados de segurança e eficácia analisados e chancelados pela agência.
O remédio é indicado para pessoas hospitalizadas com quadro de pneumonia e que precisam de suporte de oxigênio, desde que não estejam em ventilação mecânica.
O pedido foi feito em 6 de agosto pela Gilead Sciences, que produz o medicamento. Segundo a equipe técnica da Anvisa, como os estudos ainda estão sendo desenvolvidos e aprimorados, há pontos extras a serem acompanhados ao longo dos próximos meses. Apesar disso, dados de estudos realizados em outros países apontam segurança para aprovação, dizem membros da agência.
Nos EUA, também foi o primeiro tratamento para Covid-19 aprovado pela agência regulatória do país, a FDA (Food and Drug Administration).
Segundo a Gilead, o medicamento apresentou em estudos benefícios na redução da mortalidade e diminuição da necessidade de ventilação mecânica, além de redução do tempo de internação.
De acordo com a agência, para a análise foram verificados dados de estudos com 6.283 pacientes ao todo. Um dos principais foi conduzido pelo Niaid (Instituto Nacional de Alergias e Doenças Infecciosas dos EUA), multicêntrico, randomizado (ou seja, que dividiu os pacientes em grupos de forma aleatória) e com uso de placebo, com 1.048 pacientes hospitalizados em dez países.
"Não estamos falando de cura, mas de auxílio na redução de tempo de internação", afirmou Mendes ao comentar os dados em entrevista à imprensa após o anúncio.
"Os pacientes tiveram menor tempo de recuperação. Eles levaram em média dez dias para se recuperar, em comparação a 15 dias dos que não receberam o remdesivir", diz Renata Soares, gerente de avaliação de segurança e eficácia da agência.
Ainda não há informações sobre o preço do medicamento, o que deve passar agora por análise da Cmed (Câmara de Regulação do Mercado de Medicamentos).
Mendes, no entanto, lembra que o uso deve ser restrito a hospitais. "Ele não será comercializado em farmácia. A indicação é específica nos pacientes que estão hospitalizados", reforça.
O nome comercial do medicamento será Veklury e ele será vendido como pó liofizado para solução injetável, na concentração de 100 mg. A dosagem varia conforme a etapa de tratamento, que deve ser de, pelo menos, cinco dias e não pode ultrapassar dez dias.
Em novembro de 2020, a OMS (Organização Mundial de Saúde) desaconselhou o uso do remdesivir a pacientes com Covid após a análise de quatro estudos clínicos internacionais randomizados.
Questionados, representantes da Anvisa disseram que a OMS avaliou parâmetro diferentes dos observados pela agência a partir dos estudos apresentados para o registro.
"A OMS focou prevenção de mortes, enquanto a gente focou o tempo de hospitalização de pacientes. A redução é, sim, um parâmetro válido, principalmente no contexto brasileiro. Atualmente, não temos nenhum outro medicamento com pedido de registro, temos só pedido de estudo", diz Renata Soares.
"Consideramos que era uma terapia válida por ter diminuído o tempo de internação dos pacientes, sobretudo no contexto em que temos hospitais lotados. Esse foi o racional adotado pela Anvisa e outros países."
Folhapress