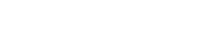Coronavirus
- Publicada em 14 de Dezembro de 2020 às 16:42Anvisa fixa prazo de 10 dias para avaliar pedidos de uso emergencial de vacinas
Anvisa tem sido pressionada para dar uma resposta ágil na liberação de vacinas
Olga MALTSEVA/AFP/JC
Agência Estado
A Agência Nacional de Vigilância Sanitária (Anvisa) informou nesta segunda-feira (14) que estabeleceu prazo de 10 dias para avaliar pedidos de uso emergencial de vacinas contra a Covid-19. Em nota, o órgão disse que trabalhará em tempo integral, inclusive nas semanas de Natal e ano novo, para analisar autorizações de importação, certificar linhas de produção e autorizações sobre uso de vacina.
Quer continuar lendo este e outros conteúdos sérios e de credibilidade?
Assine o JC Digital com desconto!
Assine o JC Digital com desconto!
- Personalize sua capa com os assuntos de seu interesse
- Acesso ilimitado aos conteúdos do site
- Acesso ao Aplicativo e versão para folhear on-line
- Conteúdos exclusivos e especializados em economia e negócios
- Cancelamento on-line e a qualquer momento
A Agência Nacional de Vigilância Sanitária (Anvisa) informou nesta segunda-feira (14) que estabeleceu prazo de 10 dias para avaliar pedidos de uso emergencial de vacinas contra a Covid-19. Em nota, o órgão disse que trabalhará em tempo integral, inclusive nas semanas de Natal e ano novo, para analisar autorizações de importação, certificar linhas de produção e autorizações sobre uso de vacina.
"Se todos os documentos necessários tenham sido submetidos à Anvisa pelos fabricantes da vacina, a Anvisa estima que o prazo de até 10 (dez) dias para concluir a avaliação quanto à autorização de uso emergencial, desde que sejam vacinas das empresas que venham apresentando dados para Anvisa e possuem ensaios clínicos em condução no Brasil", disse a agência.
Não havia prazo estabelecido para avaliação de pedidos de uso emergencial de vacinas, mas a agência já esperava se manifestar antes dos 60 dias previstos para avaliação de registro de produtos contra a Covid-19.
A Anvisa tem sido pressionada para dar uma resposta ágil na liberação de vacinas. A agência, porém, ainda não recebeu pedidos de uso emergencial. Apenas empresas que têm estudos finais de desenvolvimento de imunizantes no Brasil (fase 3) podem pedir esse aval. A aplicação emergencial deve ser feita no SUS, em grupos restritos, como de idosos ou profissionais de saúde.
Há quatro vacinas com testes de fase 3 em andamento no País: o modelo desenvolvido pela farmacêutica AstraZeneca em parceria com a Universidade Oxford, a da chinesa Sinovac em parceria com o Instituto Butantan, a das americanas Pfizer e BioNTech, além da vacina da Janssen-Cilag (Jhonson & Jhonson).